Citando a la wikipedia:
"La electroforesis es una técnica para la separación de moléculas (proteínas o ácidos nucleicos) sobre la base de su tamaño molecular y carga eléctrica. Los ácidos nucleicos ya disponen de una carga eléctrica negativa, que los dirigirá al polo positivo, mientras que las proteínas se cargan con sustancias como el SDS (detergente) que incorpora cargas negativas de una manera dependiente del peso molecular. Para la separación se usa un gel de agarosa o poliacrilamida (fibras cruzadas, como una malla). Al poner la mezcla de moléculas y aplicar un campo electrico, éstas se moveran y deberan ir pasando por la malla, por la que las pequeñas se moveran mejor, más rápidamente. Así, las más pequeñas avanzarán más y las más grandes quedarán cerca del lugar de partida."

Esta imagen muestra un clásico aparato para electroforésis vertical en un gel de poliacrilamida. Los pozos (wells) son el sitio donde se deposita la muestra y como se puede ver están cerca del polo negativo. Por lo mismo el DNA, que migra hacia el anodo, entra en el gel y corre con respecto a su tamaño. Al añadir el SDS las proteínas se desnaturalizan y se cargan negativamente, descartandose su carga original, por lo que entraran facilmente en el DNA y correrán de acuerdo a su tamaño.
Cuando las proteínas no se cargan con SDS no se cargan negativamente y por lo tanto migrarán de acuerdo a su carga nativa: Las que son negativas entrarán facilmente en el gel, mientras que las poco negativas lo harán mas lentamente y las positivas de plano no entrarán y se quedarán flotando.
El ensayo de retardo se basa en que la velocidad a la que corre un fragmento de DNA en un gel en una electroforesis se alterará si este lleva unido una proteína. La lógica es simple, si el tamaño de una proteína es X y el de un fragmento de DNA es Y, el tamaño de un complejo (Z) de la proteína con el DNA será Z=(n)X+Y. (donde n es el número de proteínas que forman el complejo con el DNA). Como es obvio cuando n es mayor de cero (al menos una proteína se une al fragmento de DNA) el valor de Z será mayor al de Y y por lo tanto el complejo migrará mas lentamente que el DNA libre.
 En esta imagen podemos ver un clásico ejemplo de un ensayo de retardo. En la columna 1 (de izq. a der.) observamos como corre el DNA de manera natural cuando no hay proteína presente (marca roja). En la columna 2 vemos como se altera el patrón cuando añadimos la mitad de cantidad de proteína de la que hay de DNA. Se mantiene la banda anterior (el DNA que no se encontró con una proteína), pero aparece una que corre mas lento (marca verde) y corresponde a los complejos que se formaron entre la proteína y el DNA. En los carriles 3 a 5 se van añadiendo cantidades crecientes de proteína y ahora solo vemos la especie cuya migración se retarda. En el carril 6 añadimo 30 veces mas proteína que DNA y la concentraciòn es tan alta que la muestra ya no es capaz de entrar en el gel. Este resultado nos muestra que la proteína que añadimos tiene la capacidad de unirse al DNA que usamos como cebo. Un experimento en que no exista interacción se vería así:
En esta imagen podemos ver un clásico ejemplo de un ensayo de retardo. En la columna 1 (de izq. a der.) observamos como corre el DNA de manera natural cuando no hay proteína presente (marca roja). En la columna 2 vemos como se altera el patrón cuando añadimos la mitad de cantidad de proteína de la que hay de DNA. Se mantiene la banda anterior (el DNA que no se encontró con una proteína), pero aparece una que corre mas lento (marca verde) y corresponde a los complejos que se formaron entre la proteína y el DNA. En los carriles 3 a 5 se van añadiendo cantidades crecientes de proteína y ahora solo vemos la especie cuya migración se retarda. En el carril 6 añadimo 30 veces mas proteína que DNA y la concentraciòn es tan alta que la muestra ya no es capaz de entrar en el gel. Este resultado nos muestra que la proteína que añadimos tiene la capacidad de unirse al DNA que usamos como cebo. Un experimento en que no exista interacción se vería así: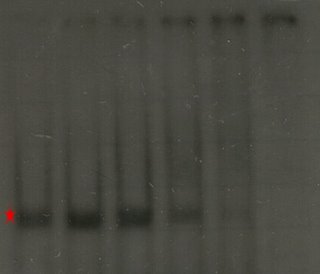 Los carriles tienen las mismas características que en la figura anterior pero en esta ocasión, por mas proteína que añadimos no se presenta la banda de m igración retardada. En los carriles 5 y 6 vemos que desaparece la banda normal, esto se debe nuevamente a que la concentración de proteína es tal que no permite la entrada de la muestra en el gel y, como se puede ver en la parte superior de la imagen, esta se queda en los pozos.
Los carriles tienen las mismas características que en la figura anterior pero en esta ocasión, por mas proteína que añadimos no se presenta la banda de m igración retardada. En los carriles 5 y 6 vemos que desaparece la banda normal, esto se debe nuevamente a que la concentración de proteína es tal que no permite la entrada de la muestra en el gel y, como se puede ver en la parte superior de la imagen, esta se queda en los pozos.Hasta ahora hemos demostrado que una proteína se puede pegar a una región de DNA y retardar su migración, sin embargo un aspecto aún mas interesante por demostrar es si esta unión es específica. Es decir, si la proteína reconoce cierta secuencia específica en el DNA que permite la interacción. Para esto utilizamos ensayos de competencia:
Si bien las bandas que hemos visto en los geles corresponden al DNA, este no se está observando de forma directa. El DNA que ponemos en nuestra electroforésis está marcado radioactivamente. Al terminar de correr el gel, este se seca y se pone a exponer contra una película fotográfica. La radioactividad en el DNA vela la película y esas son las bandas que observamos en las figuras. En el ensayo de competencia incubamos la región de DNA a estudiar, marcada radioactivamente, con la proteína que suponemos que se une a su secuencia de manera específica. Además, se añaden concentraciones crecientes de la misma región sin marcar (también llamado DNA frío) que, de acuerdo al método que usamos para observar el DNA, serían invisibles. Si la región es reconocida por la proteína, las moleculas marcadas y no marcadas competirían por ésta y al aumentar la concentración de DNA frío las mayoría de las interacciones serían entre la proteína y el DNA sin marcar, como consecuencia de esto la banda retardada disminuiría con el aumento de DNA frío, ya que la mayoría de los complejos DNA-proteína serían invisibles a la película fotográfica.
 En el carril 1 vemos el DNA sin proteína como control de la migración normal. En el carril 2 se añade una concentración equivalente de proteína como control del retardo. De los carriles 3 al 6 se añade, a una mezcla como la del carril 2, cantidades incrementadas del DNA frío que compiten con el DNA marcado por la interacción con la proteína, lo que va disminuyendo la banda correspondiente al DNA retardado.
En el carril 1 vemos el DNA sin proteína como control de la migración normal. En el carril 2 se añade una concentración equivalente de proteína como control del retardo. De los carriles 3 al 6 se añade, a una mezcla como la del carril 2, cantidades incrementadas del DNA frío que compiten con el DNA marcado por la interacción con la proteína, lo que va disminuyendo la banda correspondiente al DNA retardado.Este experimento aún no está completo, para demostrar fehacientemente debe repetirse pero, en lugar de usar la misma región de DNA como competidor, añadimos una región completamente diferenten a la región a estudiar. Si la interacción de la proteína es inepecífica con la secuencia de la región de DNA que nos interesa entonces la competencia será tan buena como la de la figura anterior. Pero, si por el contrario, la interacción es específica, entonce las moléculas frías no competirán eficientemente por la unión con la proteína y no veremos una disminución de la banda retardada:
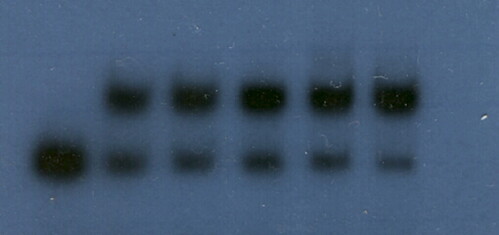 La disposición de los carriles es igual a la de la figura anterior, solo que en esta observamos que, a pesar de aumentar la cantidad de DNA frío, no solo no desaparece la banda retardada sino que tiende a aumentar. Este resultado indica que la región de DNA es incapaz de competir con nuestra región de interés por la unión con la proteína y por lo tanto, y en conjunción con el resultado del experimento anterior, podemos concluir que la interacción de la proteína con una molécula de DNA depende de que ésta tenga la misma secuencia de nucleótidos que nuestra molécula de interés, esto es la interacción es específica. El fenómeno de aumento de DNA retardado en presencia de DNA inespecífico es común y es equivalente al aumento de eficiencia de las enzimas de restricción en presencia de BSA.
La disposición de los carriles es igual a la de la figura anterior, solo que en esta observamos que, a pesar de aumentar la cantidad de DNA frío, no solo no desaparece la banda retardada sino que tiende a aumentar. Este resultado indica que la región de DNA es incapaz de competir con nuestra región de interés por la unión con la proteína y por lo tanto, y en conjunción con el resultado del experimento anterior, podemos concluir que la interacción de la proteína con una molécula de DNA depende de que ésta tenga la misma secuencia de nucleótidos que nuestra molécula de interés, esto es la interacción es específica. El fenómeno de aumento de DNA retardado en presencia de DNA inespecífico es común y es equivalente al aumento de eficiencia de las enzimas de restricción en presencia de BSA.Estas imágenes son de los resultados de mis experimentos y tal como hemos concluido la interacción de la proteína que purifiqué y que se predecía se unía a DNA es específica con la región que identifiqué en la región promotora de un gen. Al pegarse esta proteína en esta región estorba el pegado de la RNA polimerasa (mas info de la transcripción aquí) impidiendo la transcripción del gene y la síntesis de otra proteína con una función específica. Por lo tanto la proteína que purifiqué funciona como un regulador negativo de la transcripción de genes que poseen una secuencia específica en su región promotora y que es reconocida por ésta.
5 comentarios:
Cada vez me sorprendes mas!
Wow... Ciencias Genómicas! Mi hermanito perdió la razón y quiere estudiar eso!! Ya hizo el examen de admisión a la UNAM y ya se quedó, pero ahora le falta tal vez el más difícil de los retos: quedarse en esa licenciatura. ¿Qué tan difícil es? ¿Tiene mucha demanda?
Es una licenciatura muy padre y con mucho futuro. Hay 45 lugares cada año y la útlima admisión fueron 250 aspirantes y se llenaron los 45 lugares. Si quiere saber mas que revise en la página de la licenciatura porque los últimos viernes de cada mes hay pláticas con el coordinador de la carrera que es mi tutor.
LA carrera es muy demandante de tiempo y hay que saber leer inglés porque todos los textos están en ese idioma, pero si a el le gusta esto de la ciencia es una excelente opción para su formación.
Hola, escribo de Colombia de un laboratorio de genetica molecular y estoy haciendo ensayos de gel shift, pero tengo problemas con el procedimiento: se ve por donde pasa toda la banda de
DNA y proteina (queda marcado el recorido del DNA biotinilado por el carril), sabe que puede estar pasando? gracias. Mi correo es sebasgacu2@hotmail.com.
Hola, escribo de Mexico, estoy haciendo ensayos de retardo con lineas celulares de linfocitos B estimuladas con Interferon, pero cuando no estimulo a las celulas existe unión de proteína a el oligo ISRE, ¿Me puede decir cuál es la posible causa?
Publicar un comentario